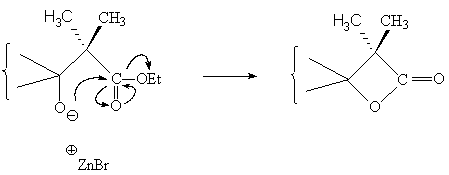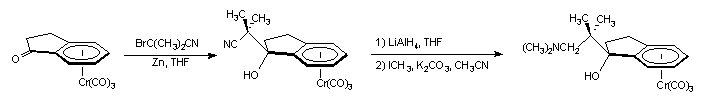
B- Application aux cétones (+)-I-1, (+)-II-1, (+)-IV-1.
Ä A partir de la cétone (+)-I-1.
Dans un premier temps, nous avons utilisé la réaction de Réformatsky sur la cétone tricarbonylchrome (+)-I-1 en présence de a -bromoisobutyronitrile et de zinc. La réaction est catalysée par HgCl2. Après hydrolyse et purification, nous obtenons le complexe cyané (+)-(S, 1S)-I-3a avec un rendement de 69 %. La fonction nitrile est ensuite réduite quantitativement par LiAlH4, puis l'amine est diméthylée en quelques heures par de l'iodure de méthyle en milieu basique. L'aminoalcool (+)-(S, 1S)-I-3b est obtenu avec un rendement global de 30 %.
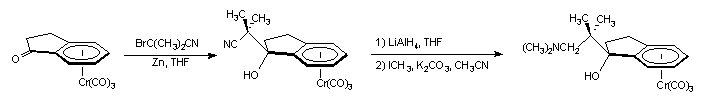
(+)-I-1 (+)-(S, 1S)-I-3a (+)-(S, 1S)-I-3b
Ä Synthèse du 1-(hydroxyindanyl)-2-méthyl-propionate d’éthyle tricarbonylchrome (+)-(S, 1S)-I-3c.
Par la suite, nous avons tenté de dialkyler le complexe (+)-(S, 1S)-I-3b par des groupements éthyles et butyles. Une première méthode consiste à chauffer durant plusieurs heures le complexe aminé à reflux d'acétonitrile ou d'éthanol en présence d'iodure d'alkyle et de K2CO3 ; sous de telles conditions, le complexe se dégrade. Une autre méthode, plus douce, a été développée par Khanna. Celle-ci, consiste à faire réagir une amine secondaire sur un ester en présence de LiAlH4 :
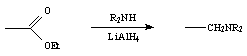
Nous nous sommes donc orientés vers la synthèse du complexe (+)-(S, 1S)-I-3c. Ce complexe est obtenu à partir du 2-bromo-2-méthyl-propanoate d’éthyle avec un rendement de 63 %. Comme nous le verrons dans le paragraphe suivant, l'hydrolyse est une étape clef et doit être effectuée à température ambiante avec de l'eau distillée.
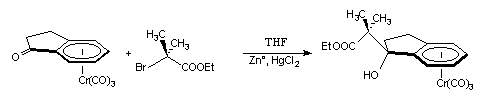
(+)-I-1 (+)-(S, 1S)-I-3c
Lorsque nous faisons la réaction de Khanna sur le complexe (+)-(S, 1S)-I-3c en présence de pyrrolidine, la solution se colore instantanément en rouge-orangé et nous récupérons la cétone initiale avec un rendement quantitatif (+)-(S)-I-1.
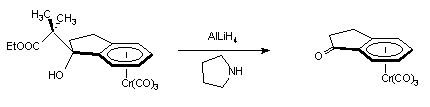
(+)-(S, 1S)-I-3c (+)-(S)-I-1
Ä Une hydrolyse singulière.
Nous avons vu précédemment que le complexe (+)-(S, 1S)-I-3c pouvait être facilement obtenu à partir de la cétone (+)-I-1 à condition d'hydrolyser le milieu à froid et avec de l'eau distillée. En effet, si nous ajoutons 1 ml de HCl dans le milieu encore à reflux (THF), nous obtenons l'indène tricarbonylchrome (+)-I-3d avec un rendement de 60 %. Pour l'instant, aucun mécanisme satisfaisant n'a pu expliquer cette réaction particulière mais diverses études sont actuellement effectuées au laboratoire pour compléter ce travail.
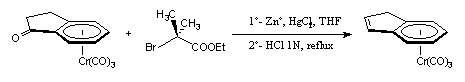
(+)-I-1 (+)-I-3d
Ä A partir de la cétone (+)-II-1.
La réaction de Réformatsky décrite précédemment a été par la suite appliquée à la cétone (+)-II-1. Dans ce cas, aucune réaction n'a eu lieu et nous récupérons la quasi totalité de la cétone initiale.

(+)-II-1
Ä A partir de la cétone IV-1
Nous avons enfin utilisé cette réaction sur la cétone ferrocénique racémique (±)-IV-1 afin d'optimiser les conditions opératoires. Cependant après hydrolyse et purification, le complexe obtenu ne correspond malheureusement pas au cyano-alcool (±)-IV-3a attendu mais nous obtenons l'a -isopropylidène[4]-(1, 2)-ferrocénophane (±)-IV-3b avec un rendement de 56 %. Si nous remplaçons l'isobutyrobromonitrile par 2-bromo-2-méthyl-propanoate d’éthyle, un résultat identique est obtenu avec rendement plus faible (27 %).

(±)-IV-1 (±)-IV-3b
Ces résultats pourraient s'expliquer par le mécanisme suivant,
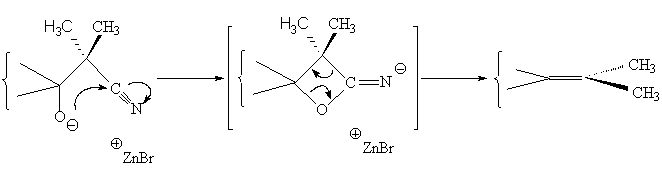
A partir du 2-bromo-2-méthyl-propanoate d’éthyle, nous pouvions espérer isoler et caractériser la lactone intermédiaire mais, malheureusement, cette espèce n'a pu être observée :