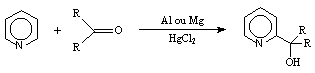
1°-2- Condensation de la pyridine.
La condensation de la pyridine sur des dérivés carbonylés présente un intérêt majeur en synthèse organique. Emmert et coll. proposèrent dès 1939 une méthode à partir d'aluminium ou de magnésium en présence de chlorure de mercure, mais présentant des rendements faibles, cette réaction fut peu utilisée en synthèse.
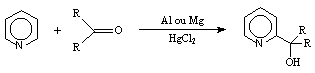
Depuis les travaux de Jones et Gilman , en 1951, la lithiation des hétérocycles tels que la pyridine est bien connue. Cependant, l'alpha métallation directe de la pyridine est difficile car les risques d'attaques nucléophiles sont importants.

Néanmoins, Clarke et coll. ont réussi la lithiation de la pyridine en présence de LDA (lithium diisopropylamide) mais, dans ces conditions, ils isolèrent le 2, 2'-bipyridine.

2, 2' bipyridine
En fait, cette métallation ne peut être obtenue que par échange halogène-métal en injectant lentement du 2-bromopyridine dans une solution de n-butyllithium dans le THF. Ce lithien hautement réactif doit être synthétisé et maintenu à basse température (-78°C) afin d'éviter tout risque de dégradation et de dimérisation. Après 20 minutes, nous obtenons la solution orangée de 2-lithiumpyridine.

orangé
Le 2-lithiopyridine peut alors être condensé sur les cétones (+)-I-1, (+)-II-1, et (+)-IV-1. Après hydrolyse et purification, nous obtenons respectivement les aminoalcools (+)-(S, 1S)-I-2, (+)-(S, 1S)-II-2, et (+)-(S, 1S)-IV-2. Les temps de réaction et les rendements sont résumés dans le tableau 1.
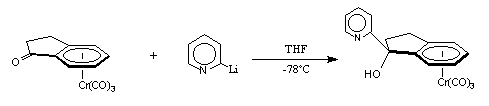
(+)-I-1 (+)-(S,1S)-I-2
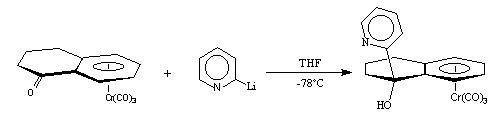
(+)-II-1(+)-(S,1S)-II-2
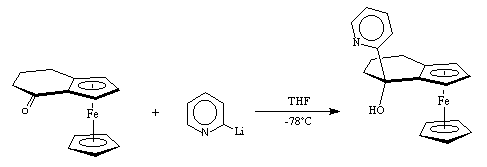
(+)-IV-1 (+)-(S,1S)-IV-2
Tableau 1 : Condensation de la pyridine sur les cétones (+)-I-1, (+)-II-1, et (+)-IV-1.
|
Cétone |
Aminoalcool |
Temps de réaction (h) |
Rendement (%) |
|
(+)-I-1 |
(+)-(S,1S)-I-2 |
3 |
71 |
|
(+)-II-1 |
(+)-(S,1S)-II-2 |
3 |
71 |
|
(+)-IV-1 |
(+)-(S,1S)-IV-2 |
3 |
55 |
2°- SYNTHESE ENANTIOSELECTIVE DE AMINOALCOOLS.
2-1°- A partir de la réaction de Réformatsky.
A- Généralités.
La réaction de Réformatsky permet la conversion d'aldéhydes et de cétones en b -hydroxyester ou en b -hydroxynitrile. Très utilisée en synthèse organique, celle-ci a fait l'objet de nombreuses études. Sous sa forme classique, cette réaction consiste en la formation d'un organozincique obtenu à partir d'un dérivé halogéné en présence de zinc. Le dérivé organométallique réagit par la suite sur un aldéhyde ou une cétone .
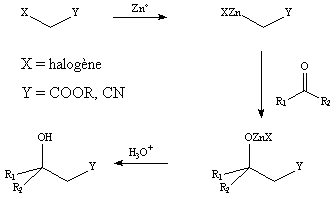
La réaction de Réformatsky est dépendante de nombreux paramètres tels que la nature du solvant, la température de réaction, l'activation du métal, ou les facteurs influençant la chimio-, la régio-, et la stéréosélectivité.
Ä Le solvant
De nombreux solvants ont été testés dans la réaction de Réformatsky. Parmi eux, le diéthyléther, le tétrahydrofurane (THF), le 1, 4-dioxanne et le diméthoxyméthane ont été privilégiés. Pour notre étude, nous avons utilisé le THF : très bon solvant des cétones (+)-I-1, (+)-II-1, (+)-IV-1.
Ä La température
La température est un facteur important dans la réaction de Réformatsky. En fait, il est nécessaire que le milieu réactionnel soit à reflux vif (110-120°C). Cette condition impose donc l'utilisation d'un ballon de réaction de grand volume surmonté d'un réfrigérant à eau possédant une grande surface de contact.
Ä Activation du zinc
Les travaux de Rieke et de Gaudemar ont montré que la métallation directe des composés halogénés par le zinc était difficile. Cependant, l'activation du zinc peut favoriser la réaction. Celle-ci se fait selon diverses méthodes : par réduction d'halogénure de zinc en présence de métaux alkalins , par du chlorure de triméthylsilane, ou par ultrason. Solladié-Cavallo et coll. établirent, par exemple, l'unique méthode de synthése de dérivés perfluoroalkyl aryl carbinols avec de bons rendements par addition, sous ultrason, d'iodure de perfluoroalkyle au benzaldéhyde tricarbonylchrome dans une suspension de zinc.

Rf = C2F5, iC3F7, C6F13.
Pour nos synthèses, nous avons utilisé du zinc en poudre activé selon la méthode de Ruppert et White : la poudre de zinc, déposée sur un verre fritté, est lavée par une solution d'acide chlorhydrique 1N, puis rincée à l'eau, à l'acétone et à l'éther éthylique. Le métal est ensuite séché à l'étuve à 80°C pendant 30 minutes au moins. Après ce traitement, le zinc doit être utilisé rapidement (24 heures au maximum).
Ä Stéréosélectivité
La première réaction de Réformatsky asymétrique fut établie par Guetté et coll. en 1973 en présence d'une diamine chirale : la (-)-sparteine. Par la suite, Soai et coll. utilisèrent des aminoalcools à base de proline ou d'éphédrine. Depuis ces travaux précurseurs, la littérature est riche d'exemples de catalyseurs tentés dans cette réaction.
Une autre approche établie au laboratoire montra l'excellente diastéréoselectivité (67 à 100 %) de la réaction de Réformatsky sur des aldéhydes tricarbonylchrome orthosubstitués.
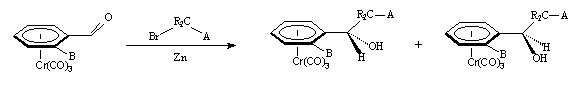
A = COOMe, COOtBu, CN.
B = Me, OMe.
R = H, Me.