SECONDE PARTIE
Synthèse énantioselective de complexes aminoalcools cycliques arènetricarbonylchrome et férrocénique
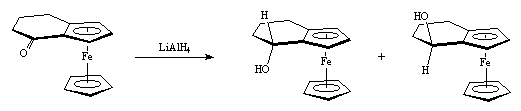
.L'encombrement stérique important du tripode Cr(CO)3 ou du groupement ferrocénique protège la face endo des arènes vis-à-vis des réactifs. Cette attaque a donc lieu uniquement sur la face opposée au groupement métallique. Ainsi, en 1960, Triflan et Backsai ont montré que : la réduction de la cétone ferrocénique IV-1 par LiAlH4 conduit à 90 % d'alcool exo (syn) et à 10 % d'alcool endo (anti) :

IV-1exo (90 %)endo (10 %)
Par la suite, Jaouen et coll. ont montré que l'attaque des nucléophiles sur les complexes arènetricarbonylchrome de l'indan-1-one I-1 et du tétral-1-one II-1 était aussi stéréospécifique.
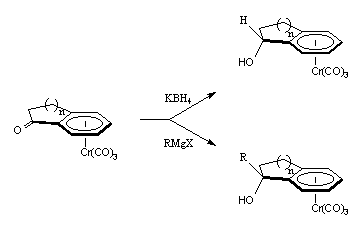
n = 1 : I-1 et n = 2 : II-1.
1°- SYNTHESE ENANTIOSELECTIVE DE AMINOALCOOLS.
1°-1- Synthèse de b aminoalcools tricarbonylchrome.
Ä Etude bibliographique.
Il existe deux méthodes classiques de synthèse de b aminoalcools à partir d'aldéhydes ou de cétones. Elles consistent en la condensation de groupements cyanure ou nitrométhane, suivie d'une réduction de ces groupements en amine.

Au début, la condensation du cyanure CN- sur une fonction carboxyle était effectuée en présence de cyanogène HCN. Puis Nagata et coll. proposèrent plutôt d'utiliser le cyanure de diéthylaluminum (Et2AlCN), plus réactif. Cependant, ces réactions sont réversibles. Afin de remédier à cet inconvénient, Evans et coll. utilisèrent le cyanure de triméthylsilane (TMSCN, Me3SiCN). Ce réactif permet d'obtenir directement l' a -silyloxynitrile dont la fonction alcool est protégée par un groupement triméthylsilane, ainsi la réaction n'est plus réversible. Evans et coll. montrèrent également que l'utilisation d'acides de Lewis tels que ZnI2 ou des éthers couronnes dans cette réaction améliorait notablement le rendement. Le TMSCN, toxique et sensible à humidité, est très délicat à synthétiser. Ainsi, en 1978, Rasmussen et coll. proposèrent de le produire in situ à partir de Me3SiCl et de KCN.
Cette dernière méthode qui impose des temps de réaction longs à de hautes températures fut améliorée par Sukata en fixant les sels de cyanure sur une résine XAD.
Pour terminer, le groupement nitrile est réduit en amine par la méthode de Nelson en présence de LiAlH4. Cette réduction conduit également à la déprotection de l'alcool.
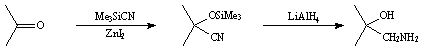
En 1987, Solladié-Cavallo et coll. utilisèrent le TMSCN pour obtenir des b -aminoalcools tricarbonylchrome à partir de benzaldéhydes ortho substitués tricarbonylchrome. Ces chercheurs montrèrent également la très haute diastéréosélectivité (80 à 100 %) de l'addition de ce réactif sur ces complexes. Après décomplexation, les a -silyloxynitriles obtenus sont réduits en aminoalcools de type éphedrine par LiAlH4 ou MeMgI/LiAlH4. La condensation du nitrométhane en présence d'un grand excès de KF donna aussi de bonnes selectivités (d.e. 86 %).
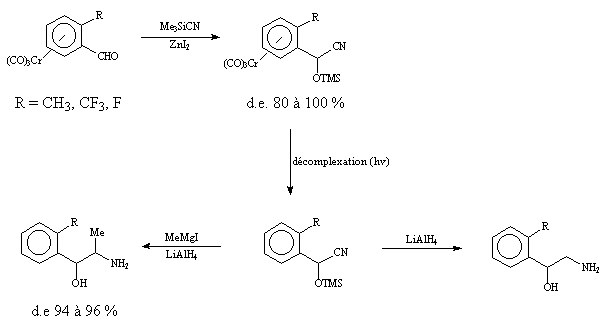
Ä Application à l'indan-1-one tricarbonylchrome (± )-I-1.
Nous avons utilisé l'ensemble de ces réactifs sur l'indan-1-one tricarbonylchrome (± )-I-1. Malheusement, malgré de nombreuses tentatives et des conditions de réactions variées, ces essais ont été infructueux et nous récupérons intégralement la cétone initiale.

Nous savons que la condensation du groupement nitrile est réversible et impose la protection de la fonction hydroxyle par le triméthylsilane (-OSiMe3). Ce groupement protecteur comme le greffon tricarbonylchrome possède un encombrement stérique important d'où une gène stérique de ces groupements l'un par rapport à l'autre : la protection par SiMe3 ne peut donc se faire. De plus, le tripode Cr(CO)3 est très attracteur et favorise la forme énol de la cétone I-1, moins réactive.
Ä Réversibilité des condensations sur la cétone I-1 : Approche expérimentale.
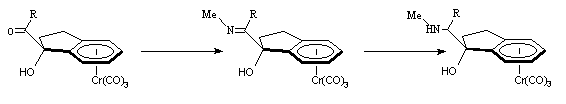
Afin d'obtenir des b -aminoalcools, nous nous sommes orientés vers la synthèse des hydroxycétones I-1c (R = H) et I-1d (R = CH3). Ces complexes seront ensuite convertis en imine puis réduit en aminoalcool :
I-1c : R = H
I-1d : R = CH3
Nous avons, tout abord, condensé le 2-lithio-1,3-dithiane et le 2-lithio-2-méthyl-1,3-dithiane sur la cétone I-1. les complexes I-1a et I-1b sont obtenus avec des rendements de 69 % et de 46 % respectivement :
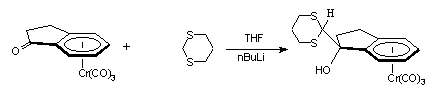
I-1 I-1a
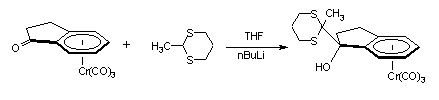
I-1 I-1b
Les complexes I-1a et I-1b sont ensuite soumis à l'action du triméthyloxonium tétrafluoroborate (Me3O+,BF4-) afin de libérer la fonction carbonyle. Pour le complexe I-1a, cette étape conduit à l'indan-1-one tricarbonylchrome initiale (rendement 90 %). Cependant, la déprotection du complexe I-1b fut plus performante et le complexe I-1d a pu être isolé avec un rendement de 80 % :

I-1a I-1
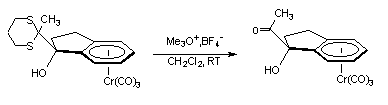
I-1b I-1d
Le complexe I-1d est converti en imine I-1e. Instable, cette imine est difficile à purifier et à manipuler. Après les analyses R.M.N 1H et infra-rouge confirmant la transformation de la fonction cétone en imine, le brut de réaction est soumis à une attaque nucléophile en présence de MeLi et conduit exclusivement au diol I-1f :
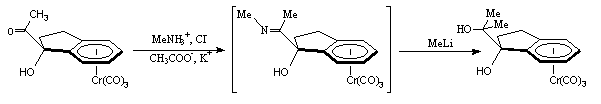
I-1d I-1e I-1f
Afin de réduire l'influence de l'alcool, nous avons tenté de la protéger par du chlorure de triméthylsilane. Après quelques minutes, la solution initialement jaune prend une couleur orangée : le complexe I-1d se dégrade et nous récupérons de nouveau la cétone initiale I-1 avec un rendement de 90 % :
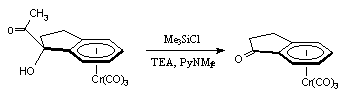
I-1d I-1
D'après ces résultats, nous pouvons confirmer la grande instabilité des complexes possédant un groupement attracteur en position 1 de l'indan-1-ol tricarbonylchrome. Ceux-ci se réarrangent très facilement en cétone après élimination du substituant attracteur. Cet effet est d'autant plus important que le groupement est attracteur.